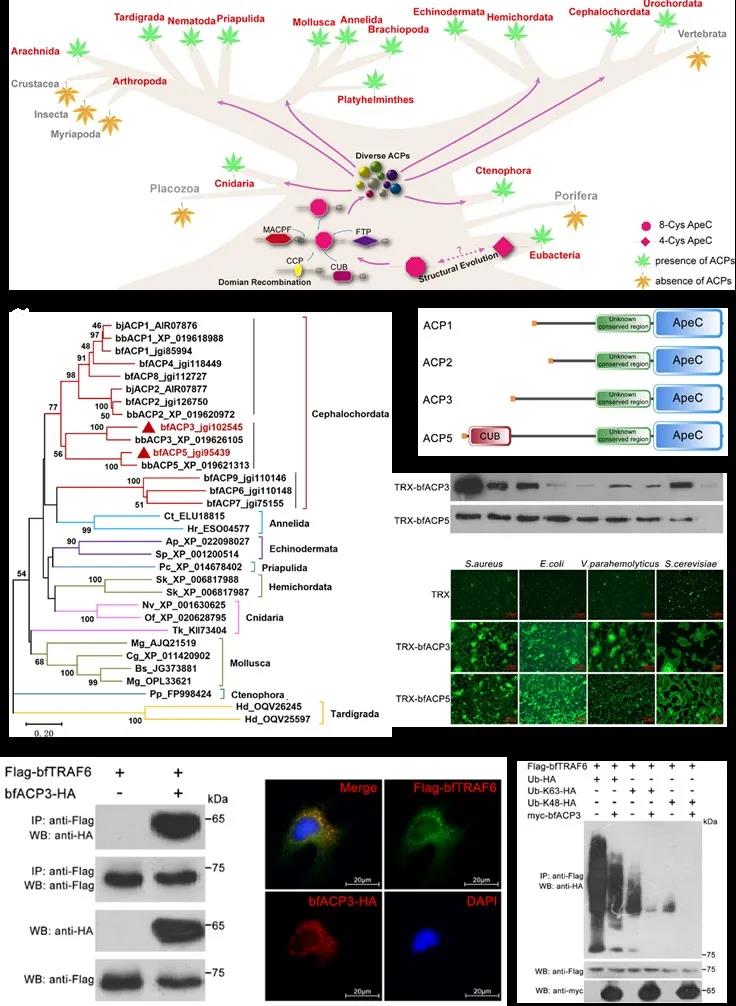
Apextrin样蛋白是海洋无脊椎动物独有的一类新型蛋白,其特征结构具备黏附结合能力。基因表达谱和蛋白组织分布表明它们参与了滤食、抗菌免疫、体表黏附和礁石固着等多种生理过程,但其物种分布、结构组成和功能机理尚未被深入研究。
我实验室海洋生命过程与生物资源利用创新团队前期研究发现大量Apextrin样蛋白存在于包括腔肠动物、软体动物、棘皮动物、文昌鱼和尾索动物在内至少15个无脊椎动物门或者亚门中。当中绝大部分物种属于海洋动物,而且属于底栖生活或固着生活的动物。结合前期工作,该研究对比分析了在文昌鱼的鳃、皮肤和肠道中4个高表达的Apextrin样蛋白的结构和功能。结果显示:四个蛋白起源相同,具有相似的蛋白架构,均能识别细菌肽聚糖,具备细菌凝集作用,但不杀菌。分泌到细胞外的蛋白若被中和掉,则会导致鳃失去保护,从而被细菌侵蚀破坏。而滞留在细胞内的蛋白,可以感应肽聚糖及其亚基团的浓度,负反馈调控核转录因子(NF-κB)信号通路,以此调节免疫反应。另一方面,四个蛋白的组织表达谱各有差异,蛋白序列也各具特色,因而体现出不同的肽聚糖结合活性、细菌结合活性和信号通路调节活性,这表明了它们已经产生了明显的功能分化。
本研究从众多Apextrin样蛋白中,成功定义了一个功能结构相近、但成员分工不同的Apextrin样蛋白子家族。该家族具备双重功能:细胞外行使细菌凝集素功能、细胞内行使信号通路调节功能。该研究为揭示更多海洋动物Apextrin样蛋白的功能提供了重要参考。
图1. Apextrin样蛋白的物种分布及文昌鱼ACP家族的功能研究 研究成果于2021年7月在期刊Frontiers in Immunology(中科院SCI二区,影响因子为7.561)上发表,题目为“Two amphioxus ApeC-containing proteins bind to microbes and inhibit the TRAF6 Pathway”。中山大学研究生李进为文章的第一作者,团队核心成员黄盛丰教授和中山大学生命科学学院徐安龙教授为文章共同通讯作者。 该研究得到了国家自然科学基金及南方海洋实验室创新团队建设科研经费的支持。